Гепатит В – его виды, причины, симптомы, способы лечения и профилактики |

Гепатит В

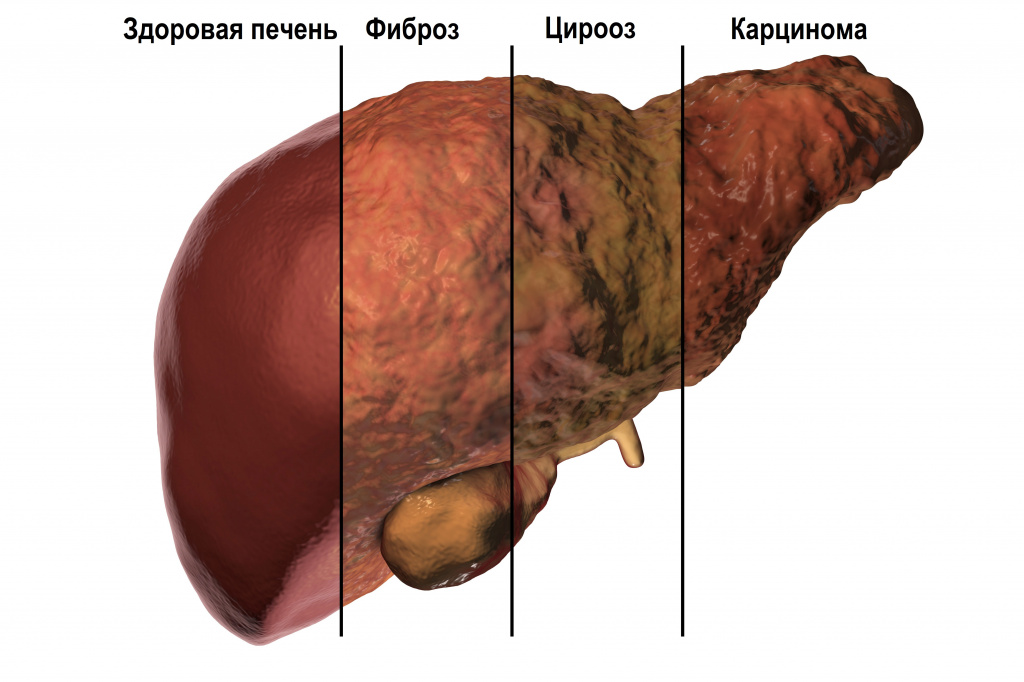
Инфекция, вызванная вирусом гепатита В (ВГВ), представляет собой глобальную проблему общественного здравоохранения. Спектр клинических проявлений ВГВ-инфекции варьирует как при остром, так и при хроническом течении заболевания. Во время острой фазы проявления варьируют от субклинического гепатита до безжелтушного гепатита, желтушного гепатита и фульминантного (молниеносного) гепатита, во время хронической фазы проявления варьируют от бессимптомного носительства до хронического гепатита, цирроза печени и гепатоцеллюлярной карциномы. Клинический исход ВГВ-инфекции зависит от возраста инфицирования, уровня репликации ВГВ и иммунного статуса хозяина.
Вирус гепатита В

- Оболочки, состоящая из белков, кодируемых вирусом, и липидных компонентов организма-хозяина.
- Центральной частицы, состоящая из белка нуклеокапсида, вирусного генома и белка-полимеразы.
ВГВ также продуцирует субвирусные частицы размером 22 нм в форме нитей и сфер, которые состоят только из белков оболочки. Эти субвирусные частицы не содержат генома и поэтому неинфекционны.
Вирус гепатита В подразделяется на 10 генотипов (от A до J) на основании межгрупповой дивергенции полной последовательности нуклеотидов на 8 и более процентов. Разные генотипы вируса связаны с разным риском развития гепатоцеллюлярной карциномы и ответом на терапию интерфероном.
Патогенез гепатита В
В целом, ВГВ не является цитопатическим вирусом, и связанное с ВГВ повреждение печени в основном опосредовано иммунитетом, однако постоянная репликация ВГВ на высоком уровне связана с повышенным риском неблагоприятных клинических исходов, что указывает на важность как вируса, так и иммунного ответа хозяина. Хотя отсутствие поверхностного антигена часто называют «функциональным излечением», редкое, но хорошо задокументированное возобновление виремии у пациентов, получающих иммуносупрессивную терапию, показывает, что полное удаление вируса может не произойти никогда. Спокойное или неактивное заболевание указывает на то, что вирус подавляется иммунным ответом хозяина. У людей с хронической ВГВ-инфекцией различные фазы представляют собой изменения в балансе между иммунным ответом хозяина и репликацией ВГВ.
При разрешении острой инфекции наблюдается выраженный поликлональный и мультиспецифический ответ CD8+ Т-клеток. У хронически инфицированных людей Т-клеточный ответ слабый и ограниченный. ВГВ-специфические Т-клетки поддерживаются в дисфункциональном или истощенном состоянии, но не исчезают полностью. Повышение реактивности ВГВ-специфических Т-клеток отмечается у пациентов, у которых спонтанно или в результате лечения наблюдается отсутствие HBeAg или HBsAg. Хотя иммунный ответ хозяина у пациентов с хронической ВГВ-инфекцией может быть неэффективным в элиминации вируса, он может опосредовать повреждение печени. Таким образом, иммунный ответ оказывается палкой о двух концах.
Эпидемиология гепатита В
По оценкам, около двух миллиардов человек во всем мире имеют признаки прошлой или настоящей инфекции ВГВ, а 296 миллионов человек являются хроническими носителями, т. е. имеют положительный результат на поверхностный антиген гепатита В [HBsAg]). Сообщается, что общая распространенность HBsAg составляет 3,5 процента, однако она варьирует в зависимости от географического региона. Распространенность является самой высокой в Западной части Тихого океана, на которую приходится 116 миллионов инфекций, затем следует Африканский регион, на который приходится 81 миллион, а затем регион Восточного Средиземноморья и Юго-Восточной Азии, на каждый из которых приходится 60 миллионов инфекций. На Европу и Америку приходится 14 и 5 миллионов соответственно.
Среди детей в возрасте до пяти лет распространенность хронического ВГВ составляет менее 1 процента. Более низкая распространенность среди детей в возрасте до пяти лет отражает эффективность глобальной программы вакцинации против гепатита В. Тем не менее, существует потребность в более широком охвате вакцинацией, в частности вакциной против ВГВ при рождении, для полной ликвидации инфекции ВГВ среди детей.
Пути передачи вирусного гепатита В
ВГВ передается от инфицированных пациентов тем, у кого нет иммунитета (т. е. отрицательные по анти-HBsAg. Вакцинация против гепатита В значительно снизила риск передачи во всем мире.
Преобладающий путь передачи ВГВ различается в разных географических районах. Передача от матери к ребенку является преобладающим способом передачи в районах с высокой распространенностью. Уровень инфицирования младенцев, рожденных от матерей с положительным HBsAg, достигает 90 процентов среди младенцев, которые не получают иммуноглобулин против гепатита В и вакцинацию против гепатита В при рождении. Передача инфекции от матери к ребенку может происходить внутриутробно, во время родов или после рождения. Тем не менее, большинство инфекций происходит во время родов. Грудное вскармливание не увеличивает риск передачи инфекции.
Для сравнения, на горизонтальную передачу, особенно в раннем детстве, приходится большинство случаев хронической инфекции ВГВ в районах с промежуточной распространенностью, в то время как незащищенные половые сношения и употребление инъекционных наркотиков у взрослых являются основными путями распространения в районах с низкой распространенностью.
Риск заражения ВГВ при переливании крови варьируется в зависимости от распространенности ВГВ. В странах с низкой распространенностью ВГВ риск может варьироваться от
Передача половым путем. Передача половым путем остается распространенным источником передачи ВГВ. Например, в одном отчете, в котором оценивались 2220 случаев острой инфекции ВГВ, считалось, что сексуальный риск является причиной передачи ВГВ примерно в 35 процентах случаев. Невакцинированные мужчины, имеющие половые контакты с мужчинами, и гетеросексуальные лица, имеющие несколько половых партнеров или контактирующие с секс-работниками, подвергаются особенно высокому риску.
ВГВ может передаваться в медицинских учреждениях. В одном отчете описывается 25 вспышек гепатита В, связанных с оказанием медицинской помощи (два или более случаев), зарегистрированных в период с 2008 по 2019 год. В каждом случае имели место множественные нарушения протоколов инфекционного контроля.
Внутрибольничная передача обычно происходит от пациента к пациенту или от пациента к поставщику медицинских услуг через загрязненные инструменты или случайный укол иглой. Число ВГВ-инфекций среди медицинских работников значительно снизилось, в значительной степени благодаря применению универсальных мер предосторожности, усилиям, направленным на иммунизацию всех медицинских работников против ВГВ, и использованию постконтактной профилактики для неиммунных лиц.
ВГВ-инфекция может передаваться от HBsAg-положительных доноров к HBsAg-отрицательным реципиентам с тяжелыми клиническими последствиями, если реципиент не имеет иммунитета. Сообщалось о передаче ВГВ-инфекции после трансплантации гемопоэтических стволовых клеток и паренхиматозных органов. Среди реципиентов паренхиматозных органов риск посттрансплантационной инфекции HBV наблюдается в первую очередь среди серонегативных реципиентов печени. Однако случаи также были зарегистрированы среди тех, кто получил внепеченочные органы, такие как почки, и даже бессосудистые ткани, такие как роговица, от HBsAg-положительных доноров
Другие пути передачи. Взрослые и дети могут заразиться ВГВ при контакте с кровью при незначительных повреждениях кожи или слизистых оболочек. Кроме того, передача может происходить при контакте с предметами домашнего обихода, которые были загрязнены кровью, такими как зубные щетки, бритвы и игрушки, поскольку ВГВ может сохраняться вне человеческого организма в течение длительного времени. Хотя ДНК ВГВ была обнаружена в различных выделениях организма носителей гепатита В, нет убедительных доказательств передачи ВГВ через биологические жидкости, кроме крови или спермы.
Острый гепатит В

Приблизительно у 70 процентов пациентов с острым вирусным гепатитом В (ВГВ) наблюдается субклинический или безжелтушный гепатит, а у 30 процентов развивается желтушный гепатит. Заболевание может быть более тяжелым у пациентов с коинфекцией другими вирусами гепатита или с сопутствующим заболеванием печени.
Фульминантная печеночная недостаточность встречается редко, примерно у 0,1–0,5 процента пациентов. Считается, что фульминантный гепатит В обусловлен массивным иммуноопосредованным лизисом инфицированных гепатоцитов. Это объясняет, почему у многих пациентов с фульминантным гепатитом В при поступлении нет признаков репликации ВГВ.
Причины, по которым ВГВ имеет молниеносное течение у некоторых пациентов, до конца не изучены. В исследовании случай-контроль оценивались факторы риска фульминантного течения вспышки среди потребителей инъекционных наркотиков. По сравнению с пациентами контрольной группы пациенты случая чаще употребляли парацетамол во время болезни (p = 0,08), употребляли больше алкоголя и метамфетамина и больше теряли вес за шесть месяцев до болезни. Кроме того, все девять изолятов имели генотип D. Неясно, привели ли вирусные факторы или факторы окружающей среды к фульминантному течению этой вспышки, или же факторы риска, выявленные в этой вспышке, могут быть обобщены на острый ВГВ в других условиях.
Инкубационный период длится от одного до четырех месяцев. В продромальный период может развиться синдром, подобный сывороточной болезни, за которым следуют конституциональные симптомы, анорексия, тошнота, желтуха и дискомфорт в правом подреберье. Симптомы и желтуха обычно исчезают через 1–3 месяца, но у некоторых пациентов сохраняется длительная усталость даже после нормализации концентрации аминотрансфераз в сыворотке.
Лабораторные исследования в острой фазе выявляют повышение концентрации аланина и аспартатаминотрансферазы (АЛТ и АСТ), значения до 1000–2000 ЕД/л обычно наблюдаются во время острой фазы, при этом АЛТ выше, чем АСТ. Концентрация билирубина в сыворотке крови может быть нормальной у пациентов с безжелтушным гепатитом. Протромбиновое время является лучшим показателем прогноза. У выздоравливающих больных нормализация сывороточных аминотрансфераз обычно происходит в течение одного-четырех месяцев. Стойкое повышение уровня АЛТ в сыворотке в течение более шести месяцев свидетельствует о прогрессировании гепатита в хронический.
Скорость прогрессирования острого гепатита В в хронический у иммунокомпетентных лиц определяется, прежде всего, возрастом инфицирования. Показатель составляет примерно 90 процентов для перинатальной инфекции, от 20 до 50 процентов для инфекций в возрасте от одного до пяти лет и менее 5 процентов для инфекций, приобретенных взрослыми.
Хронический гепатит В

Многие пациенты с хроническим ВГВ болеют бессимптомно, если только у них нет декомпенсированного цирроза печени или внепеченочных проявлений, в то время как у некоторых наблюдаются лишь неспецифические симптомы, такие как повышенная утомляемость. У некоторых пациентов наблюдаются обострения инфекции, которые могут протекать бессимптомно, имитировать острый гепатит или проявляться в виде печеночной недостаточности.
Данные физикального обследования могут быть нормальными или могут свидетельствовать о хроническом заболевании печени. У пациентов с декомпенсированным циррозом печени могут наблюдаться желтуха, спленомегалия, асцит, периферические отеки и энцефалопатия. Лабораторные анализы могут быть в пределах норма, но у большинства пациентов наблюдается умеренное повышение уровня АСТ и АЛТ в сыворотке крови. Во время обострений концентрация АЛТ в сыворотке может 50-кратно превышать верхнюю границу нормы, а концентрации альфа-фетопротеина (АФП) – достигать 1000 нг/мл. Прогрессирование в цирроз печени подозревается при наличии признаков гиперспленизма (снижение числа лейкоцитов и тромбоцитов) или нарушения синтетической функции печени (гипоальбуминемия, удлинение протромбинового времени, гипербилирубинемия).
Считается, что внепеченочные проявления опосредованы циркулирующими иммунными комплексами. Как упоминалось выше, острый гепатит может предшествовать синдрому, подобному сывороточной болезни, проявляющемуся лихорадкой, кожной сыпью, артралгией и артритом, который обычно проходит с появлением желтухи. Двумя основными внепеченочными осложнениями хронического ВГВ являются узелковый полиартериит и гломерулярная болезнь.
- Разная доля пациентов с узелковым полиартериитом является положительной на HBsAg. Клинические проявления аналогичны таковым у пациентов с полиартериитом, которые являются ВГВ-негативными. Пациентам с полиартериитом, связанным с ВГВ, может помочь противовирусная терапия.
- ВГВ может вызывать как мембранозную нефропатию, так и, реже, мембранопролиферативный гломерулонефрит. Большинство случаев гломерулонефропатии, связанной с ВГВ, возникает у детей. Типичным проявлением является протеинурия нефротического диапазона. Приблизительно у 30–60 процентов детей с мембранозной нефропатией, связанной с ВГВ, наступает спонтанная ремиссия, обычно в связи с сероконверсией е-антигена гепатита В в антитела (HBeAg в анти-HBe). Может развиться почечная недостаточность, особенно у взрослых. Эффективность противовирусной терапии сомнительна.
- Описана связь апластической анемии с инфекцией ВГВ, хотя в большинстве случаев постгепатитная апластическая анемия не связана с ВГВ.
Фазы хронического гепатита В
Хроническая инфекция ВГВ обычно состоит из четырех фаз, хотя не все пациенты проходят все четыре, и хотя большинство пациентов переходят от одной фазы к другой, иногда может происходить возврат и к более ранней фазе.
Иммунная толерантность. У пациентов с перинатально приобретенной инфекцией ВГВ начальная фаза характеризуется высокими уровнями репликации ВГВ — наличием е-антигена гепатита В (HBeAg) и высокими уровнями ДНК ВГВ в сыворотке — но отсутствием признаков активного заболевания печени. что проявляется отсутствием симптомов, нормальной концентрацией АЛТ в сыворотке и минимальными изменениями при биопсии печени. Два исследования показали, что от 30 до 50 процентов пациентов в этой фазе имели стадию 0, в то время как у других была стадия фиброза I. Одно из этих исследований показало, что показатели фиброза при повторных биопсиях не изменились через пять лет у пациентов, оставшихся в фазе иммунологической толерантности. Может длиться 10–30 лет.
Иммуноактивный, HBeAg-положительный. Переход от иммунологической толерантности к иммуноактивной фазе или фазе клиренса происходит в течение второй и третьей декады у пациентов с перинатально приобретенной HBV-инфекцией. Во время этой фазы спонтанный клиренс е-антигена гепатита В (HBeAg) увеличивается до 10–20 процентов в год. Уровень сероконверсии 70 процентов в течение 10 лет наблюдения был описан в популяционном исследовании 1536 аборигенов Аляски, которые заразились ВГВ во взрослом возрасте. Несколько исследований в Азии показали, что у пациентов с инфекцией генотипа B сероконверсия HBeAg происходит в более раннем возрасте, чем у пациентов с инфекцией генотипа C. Сероконверсия HBeAg часто, но не всегда, сопровождается биохимическими обострениями (резкое повышение уровня АЛТ в сыворотке).
В большинстве случаев обострения протекают бессимптомно и выявляются при плановом диспансерном наблюдении. Однако некоторые из них сопровождаются симптомами острого гепатита и могут привести к неправильной диагностике острого гепатита В у пациентов, о которых ранее не было известно, что они имеют хроническую инфекцию ВГВ. Обострения могут быть связаны с повышением титра основных антител IgM гепатита В (анти-HBc), что может привести к неправильной диагностике острой инфекции ВГВ и повышению концентрации альфа-фетопротеина в сыворотке. Обострения чаще наблюдаются у мужчин, чем у женщин, почему – неясно.
Неактивный хронический ВГВ. Пациенты в низкой фазе или в нереплицирующейся фазе/неактивном носительстве являются HBeAg-отрицательными и анти-HBe-положительными. У некоторых пациентов ДНК ВГВ не обнаруживается в сыворотке, а заболевание печени находится в стадии ремиссии, о чем свидетельствуют нормальные концентрации АЛТ в сыворотке и разрешение некротических и воспалительных процессов в биоптатах печени. Одно исследование показало, что около 40 процентов неактивных носителей имели уровни ДНК HBV 10 4 копий/мл (>2000 международных единиц/мл) или выше.
Иммуноактивный, HBeAg-отрицательный. У некоторых пациентов сохраняется умеренный уровень репликации ВГВ и активное заболевание печени (повышенный уровень АЛТ в сыворотке и хроническое воспаление при биопсии печени), но они остаются отрицательными по e-антигену гепатита B (HBeAg). У таких пациентов говорят о HBeAg-негативном хроническом гепатите. У них есть остаточный вирус дикого типа или варианты ВГВ, которые не могут продуцировать HBeAg из-за генетических вариаций пре-ядра или ядра-промотора. Пациенты с HBeAg-негативным иммуноактивным хроническим гепатитом В старше и имеют более выраженное заболевание печени. У них также есть тенденция к колебаниям уровней ДНК ВГВ и АЛТ.
Важно! Некоторые пациенты с хронической инфекцией HBV становятся HBsAg-негативными естественным путём, без какого-либо лечения. Годовой уровень отсроченной элиминации HBsAg оценивается в 0,5–2 процента у западных пациентов и намного ниже (0,1–0,8 процента) в азиатских странах.
Лечение гепатита В

Лечение острого ВГВ зависит от клинической ситуации. Тем не менее, следует принять соответствующие меры для предотвращения инфицирования всех контактов, и иммуноглобулин против гепатита В и вакцину против гепатита В следует вводить всем бытовым и половым контактам, о которых не известно, что они обладают иммунитетом. Для большинства пациентов лечение в основном поддерживающее. Существуют известные подгруппы пациентов, чей прогноз относительно хуже (например, пациенты с ослабленным иммунитетом, имеющие сопутствующую инфекцию гепатитом С или вирусом иммунодефицита человека [ВГС или ВИЧ], имеющие ранее существовавшие заболевания печени или пожилые люди), но роль противовирусной терапии для таких пациентов остается неясной, поскольку в крайне небольшом числе исследований изучались ее преимущества при острой инфекции.
Лечение хронического ВГВ является сложным и зависит от множества факторов, включая клинические переменные (например, наличие или отсутствие воспаления печени и/или цирроза), иммунологический ответ пациента на инфекцию (например, статус е-антигена гепатита В [HBeAg]) , вирусологические факторы (например, вирусная нагрузка и генотип HBV) и факторы риска прогрессирования заболевания (например, возраст > 40 лет и семейный анамнез гепатоцеллюлярной карциномы).
В настоящее время существует восемь утвержденных препаратов для лечения гепатита В. Эти препараты эффективны в подавлении репликации ВГВ, но они не уничтожают ВГВ, поэтому большинству пациентов требуется длительное, а иногда и пожизненное лечение для поддержания клинического эффекта.
Целью лечения гепатита В является достижение устойчивого подавления репликации ВГВ и ремиссии заболевания печени. Конечной целью является предотвращение цирроза, печеночной недостаточности и ГЦК. Для оценки ответа на лечение используются такие параметры, как снижение уровня ДНК ВГВ в сыворотке крови, потеря HBeAg с или без сероконверсии к анти-HBe, потеря HBsAg с или без сероконверсии к анти-HBs, нормализация АЛТ в сыворотке крови, улучшение гистологии печени (уменьшение некровоспаления +/- уменьшение фиброза) или обратное развитие фиброза печени, определяемое неинвазивными методами.
Интерферон обладает противовирусной и иммуномодулирующей активностью и был первым препаратом, одобренным для лечения гепатита В. Последние исследования показывают, что он также может ингибировать инкапсидацию прегеномной РНК, усиливать деградацию кзцДНК и влиять на эпигенетическую модификацию кзцДНК. Пегилированный ИФ вытеснил обычный ИФ благодаря более удобному графику дозирования и повышенной эффективности.
Шесть аналогов нуклеозидов/нуклеотидов можно разделить на три группы: l-нуклеозиды - ламивудин и телбивудин, фосфонаты ациклических нуклеозидов - адефовира дипивоксил, тенофовира дизопроксила фумарат и тенофовира алафенамид, и аналоги дезоксигуанозина - энтекавир. Тенофовира алафенамид более стабилен в плазме крови, чем тенофовира дизопроксила фумарат, и более эффективно доставляет активный метаболит в гепатоциты, что позволяет использовать более низкую дозу при одинаковой противовирусной активности, меньшей системной экспозиции и снижении почечной и костной токсичности. NA действуют главным образом путем ингибирования обратной транскрипции прегеномной РНК в ДНК ВГВ. Они не оказывают прямого ингибирующего действия на кзцДНК, поэтому при прекращении лечения часто наблюдается рецидив вируса. NA оказывают минимальное влияние на уровень HBsAg, и математическое моделирование предсказало среднюю продолжительность потери HBsAg более 50 лет, что указывает на необходимость пожизненного лечения у большинства пациентов, если целью является достижение элиминации HBsAg.
Важно! Устойчивость к противовирусным препаратам была основным ограничением для долгосрочного использования первых аналогов нуклеозидов/нуклеотидов, но энтекавир и тенофовир имеют высокий порог устойчивости.
Продолжительность и конечные точки лечения ВГВ
Пациенты, получающие терапию интерфероном, обычно придерживаются 48-недельного курса. Оптимальная продолжительность терапии пероральными препаратами точно не установлена. Большинству пациентов, получающих терапию аналогами нуклеоз(т)идов, потребуется по крайней мере четыре-пять лет лечения, а некоторым может потребоваться бессрочное лечение. В систематическом обзоре, включавшем 1716 пациентов с хроническим ВГВ, прекративших пероральную терапию (из которых у 18 процентов был цирроз печени), вирусологическая ремиссия, определяемая как ДНК ВГВ
Длительное лечение особенно важно для пациентов с циррозом печени. Это было проиллюстрировано в ретроспективном когортном исследовании 263 пациентов с хроническим гепатитом В (94 с циррозом печени), которые прекратили прием ламивудина после лечения обострения гепатита. Пациентов лечили в среднем в течение 12 месяцев, и более чем половине из них потребовалось повторное лечение после прекращения приема ламивудина. По сравнению с пациентами без цирроза, у пациентов с циррозом значительно чаще требовалось повторное лечение (64 процента против 47) и/или возникал клинический рецидив (76 процентов против 60).
Тактика при неудачном лечении ВГВ
Ведение пациентов при неудаче лечения зависит от типа неудачи, полученного лечения, истории предшествующей терапии и характеристик до лечения.
Отсутствие первоначального ответа. Пегилированный ИФ может быть отменен, а пациент переведен на лечение NA, если через 12 недель уровень HBsAg снижается минимально или вообще не снижается, поскольку вероятность устойчивого вирусологического ответа очень низка. Первоначальное снижение уровня ДНК ВГВ в сыворотке крови не является прогностическим фактором устойчивого ответа. Энтекавир и тенофовир обладают мощной противовирусной активностью, и о первичном отсутствии ответа не сообщалось.
Вирусологический прорыв после первоначального ответа на аналоги нуклеозидов/нуклеотидов. Вирусологический прорыв может быть результатом устойчивости к противовирусным препаратам или несоблюдения режима приема лекарств. Пациенты с вирусологическим прорывом должны быть проконсультированы относительно соблюдения режима приема препаратов, а прорыв должен быть подтвержден повторным анализом ДНК ВГВ в сыворотке крови через 1–3 месяца. Восстановительная терапия должна быть начата немедленно у пациентов с декомпенсированным заболеванием печени или тяжелыми вспышками гепатита и после подтверждения вирусологического прорыва у других пациентов. Тенофовир является предпочтительным препаратом, поскольку он эффективен против вариантов ВГВ, устойчивых к ламивудину, адефовиру, телбивудину и энтекавиру. Клинические исследования показали, что монотерапии тенофовиром достаточно, а добавление другого препарата той же группы не дает дополнительных преимуществ.
Профилактика ВГВ

Предэкспозиционная вакцинация. Вакцинация против ВГВ до контакта является лучшим способом предотвращения инфицирования ВГВ. Всеобщая вакцинация новорожденных рекомендуется в большинстве стран. Также предлагается вакцинация взрослых в возрасте до 60 лет, а также лиц любого возраста с высоким риском заражения ВГВ.
Постконтактная профилактика для предотвращения инфицирования ВГВ должна рассматриваться для лиц, подвергшихся воздействию, потенциально способному передать ВГВ. К ним относятся чрескожное (например, укус или укол иглой) или попадание на слизистые оболочки крови или инфекционных выделений (например, спермы, биологических жидкостей, содержащих кровь) пациента, который является HBsAg-положительным или чей HBsAg-статус неизвестен.
Необходимость постконтактной профилактики и тип профилактики зависят от истории вакцинации и статуса поверхностных антител к гепатиту В (анти-HBs) у подвергшегося воздействию пациента и статуса HBsAg у исходного пациента.
Ведение особых групп населения. Вакцинация против гепатита В до контакта является лучшим способом предотвращения передачи ВГВ. Однако для определенных групп пациентов используются и дополнительные стратегии.
- Передача от матери к ребенку. Чтобы уменьшить передачу от матери к ребенку, младенцы, рожденные от матерей с положительным HBsAg, должны получить активную и пассивную иммунизацию (т. е. вакцину против гепатита В и иммуноглобулин против гепатита В) как можно скорее и предпочтительно в течение 12 часов после рождения. Кроме того, назначение противовирусной терапии матерям с высокой вирусной нагрузкой ВГВ может дополнительно снизить риск инфицирования новорожденного.
- Половой контакт. HBsAg-положительные пациенты должны использовать презервативы для снижения риска передачи ВГВ половым путем, если их партнер не имеет иммунитета или если его иммунный статус неизвестен. Кроме того, супруги и постоянные половые партнеры пациента с хроническим ВГВ должны пройти скрининг, чтобы выяснить, не были ли они ранее инфицированы. Те, у кого нет иммунитета и нет признаков хронического гепатита В, должны быть вакцинированы, а иммунитет подтвержден тестированием на анти-HBs через один-два месяца после завершения курса вакцинации.
- Чрескожное введение. Чтобы снизить риск чрескожной передачи ВГВ (при употреблении наркотиков или пирсинге), пациенты должны быть проинформированы об использовании стерильных одноразовых игл и инструментов. Кроме того, лица, употребляющие инъекционные наркотики, должны проходить скрининг и вакцинацию против ВГВ, если они не обладают иммунитетом, вакцинация без скрининга также может рассматриваться как способ облегчить завершение вакцинации. Для таких пациентов также важно устранить основное расстройство, связанное с употреблением психоактивных веществ.
- Медицинские работники должны быть иммунизированы против ВГВ. Кроме того, медработников следует обучить методам сведения к минимуму риска контакта с патогенами, передающимися через кровь. Чтобы свести к минимуму передачу ВГВ от инфицированного медработника неинфицированному пациенту, группы руководящих органов разработали рекомендации относительно типов процедур, которые медработник может выполнять, на основе антигена е гепатита В (HBeAg) и ДНК ВГВ у инфицированного медработника.
- Реципиенты трансплантатов. Чтобы предотвратить передачу ВГВ реципиентам солидных и гемопоэтических трансплантатов, доноры регулярно проходят скрининг на HBsAg. В некоторых странах доноры также проходят скрининг на анти-HBc и ДНК HBV. Неясно, снижает ли тестирование доноров на ДНК ВГВ риск передачи ВГВ реципиентам. Например, в отчете из Франции, который включал 11115 последовательных доноров органов, тканей и клеток, ДНК ВГВ была обнаружена только у 0,07 процента лиц без серологических маркеров хронического ВГВ. Таким образом, серологическое тестирование по-прежнему является основой скрининга. Передача HBV-инфекции может происходить от HBsAg-отрицательных, анти-HBc-положительных доноров неиммунным реципиентам, особенно в условиях трансплантации печени. Для снижения этого риска рекомендуется профилактическая противовирусная терапия. Следует избегать использования HBsAg-положительных или ДНК-положительных доноров для HBV-наивных реципиентов, если доступен подходящий донор без ВГВ. Однако в ситуациях, когда это невозможно, лечение донора и/или реципиента противовирусными препаратами и иммуноглобулином может помочь снизить риск передачи.
- Ahmed MM, Huang TH, Xie QD. An improved experimental model for studying vertical transmission of hepatitis B virus via human spermatozoa // J Virol Methods 2008, 151:116.
- Andreani T, Serfaty L, Mohand D, et al. Chronic hepatitis B virus carriers in the immunotolerant phase of infection: histologic findings and outcome // Clin Gastroenterol Hepatol 2007, 5:636.
- Bialek SR, Bower WA, Mottram K, et al. Risk factors for hepatitis B in an outbreak of hepatitis B and D among injection drug users // J Urban Health 2005, 82:468.
- Challine D, Chevaliez S, Pawlotsky JM. Efficacy of serologic marker screening in identifying hepatitis B virus infection in organ, tissue, and cell donors // Gastroenterology 2008, 135:1185.
- Chan HL, Chan CK, Hui AJ, et al. Effects of tenofovir disoproxil fumarate in hepatitis B e antigen-positive patients with normal levels of alanine aminotransferase and high levels of hepatitis B virus DNA // Gastroenterology 2014, 146:1240.
- Des Jarlais DC, Diaz T, Perlis T, et al. Variability in the incidence of human immunodeficiency virus, hepatitis B virus, and hepatitis C virus infection among young injecting drug users in New York City // Am J Epidemiol 2003, 157:467.
- European Association for the Study of the Liver. Electronic address: [email protected] , European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection // J Hepatol 2017, 67:370.
- Feld JJ, Terrault NA, Lin HS, et al. Entecavir and Peginterferon Alfa-2a in Adults With Hepatitis B e Antigen-Positive Immune-Tolerant Chronic Hepatitis B Virus Infection // Hepatology 2019, 69:2338.
- Fontana RJ, Hann HW, Perrillo RP, et al. Determinants of early mortality in patients with decompensated chronic hepatitis B treated with antiviral therapy // Gastroenterology 2002, 123:719.
- GBD 2017 Cirrhosis Collaborators. The global, regional, and national burden of cirrhosis by cause in 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017 // Lancet Gastroenterol Hepatol 2020, 5:245.
- Harpaz R, Von Seidlein L, Averhoff FM, et al. Transmission of hepatitis B virus to multiple patients from a surgeon without evidence of inadequate infection control // N Engl J Med 1996, 334:549.
- Huang JM, Huang TH, Qiu HY, et al. Effects of hepatitis B virus infection on human sperm chromosomes // World J Gastroenterol 2003, 9:736.
- Hui CK, Leung N, Yuen ST, et al. Natural history and disease progression in Chinese chronic hepatitis B patients in immune-tolerant phase // Hepatology 2007, 46:395.
- Kumar M, Sarin SK, Hissar S, et al. Virologic and histologic features of chronic hepatitis B virus-infected asymptomatic patients with persistently normal ALT // Gastroenterology 2008, 134:1376.
- Kumar M, Satapathy S, Monga R, et al. A randomized controlled trial of lamivudine to treat acute hepatitis B // Hepatology 2007, 45:97.
- Kwon H, Lok AS. Hepatitis B therapy // Nat Rev Gastroenterol Hepatol 2011, 8:275.
- Lai M, Hyatt BJ, Nasser I, et al. The clinical significance of persistently normal ALT in chronic hepatitis B infection // J Hepatol 2007, 47:760.
- Lee HA, Lee HW, Kim IH, et al. Extremely low risk of hepatocellular carcinoma development in patients with chronic hepatitis B in immune-tolerant phase // Aliment Pharmacol Ther 2020, 52:196.
- Lin CL, Kao JH, Chen BF, et al. Application of hepatitis B virus genotyping and phylogenetic analysis in intrafamilial transmission of hepatitis B virus // Clin Infect Dis 2005, 41:1576.
- Mast EE, Margolis HS, Fiore AE, et al. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) part 1: immunization of infants, children, and adolescents // MMWR Recomm Rep 2005, 54:1.
- Mast EE, Weinbaum CM, Fiore AE, et al. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) Part II: immunization of adults // MMWR Recomm Rep 2006, 55:1.
- Maynard JE. Hepatitis B: global importance and need for control // Vaccine 1990, 8 Suppl:S18.
- Nelson PK, Mathers BM, Cowie B, et al. Global epidemiology of hepatitis B and hepatitis C in people who inject drugs: results of systematic reviews // Lancet 2011, 378:571.
- Ott JJ, Stevens GA, Groeger J, Wiersma ST. Global epidemiology of hepatitis B virus infection: new estimates of age-specific HBsAg seroprevalence and endemicity // Vaccine 2012, 30:2212.
- Rosenthal P, Ling SC, Belle SH, et al. Combination of Entecavir/Peginterferon Alfa-2a in Children With Hepatitis B e Antigen-Positive Immune Tolerant Chronic Hepatitis B Virus Infection // Hepatology 2019, 69:2326.
- Sarin SK, Kumar M, Lau GK, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update // Hepatol Int 2016, 10:1.
- Sinn DH, Lee J, Goo J, et al. Hepatocellular carcinoma risk in chronic hepatitis B virus-infected compensated cirrhosis patients with low viral load // Hepatology 2015, 62:694.
- Stramer SL, Notari EP, Krysztof DE, Dodd RY. Hepatitis B virus testing by minipool nucleic acid testing: does it improve blood safety? // Transfusion 2013, 53:2449.
- Terrault NA, Lok ASF, McMahon BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance // Hepatology 2018, 67:1560.
- Theodoropoulos N, Jaramillo A, Ladner DP, Ison MG. Deceased organ donor screening for HIV, hepatitis B, and hepatitis C viruses: a survey of organ procurement organization practices // Am J Transplant 2013, 13:2186.
- Thompson ND, Perz JF, Moorman AC, Holmberg SD. Nonhospital health care-associated hepatitis B and C virus transmission: United States, 1998-2008 // Ann Intern Med 2009, 150:33.
- Weinbaum CM, Williams I, Mast EE, et al. Recommendations for identification and public health management of persons with chronic hepatitis B virus infection // MMWR Recomm Rep 2008, 57:1.
- Williams IT, Perz JF, Bell BP. Viral hepatitis transmission in ambulatory health care settings // Clin Infect Dis 2004, 38:1592.
- Wong GL, Wong VW, Choi PC, et al. Evaluation of alanine transaminase and hepatitis B virus DNA to predict liver cirrhosis in hepatitis B e antigen-negative chronic hepatitis B using transient elastography // Am J Gastroenterol 2008, 103:3071.
- Yao FY, Terrault NA, Freise C, et al. Lamivudine treatment is beneficial in patients with severely decompensated cirrhosis and actively replicating hepatitis B infection awaiting liver transplantation: a comparative study using a matched, untreated cohort // Hepatology 2001, 34:411.
- Yapali S, Talaat N, Lok AS. Management of hepatitis B: our practice and how it relates to the guidelines // Clin Gastroenterol Hepatol 2014, 12:16.
- Yuan P, Chen P, Qian Y. Evaluation of Antiviral Therapy Performed after Curative Therapy in Patients with HBV-Related Hepatocellular Carcinoma: An Updated Meta-Analysis // Can J Gastroenterol Hepatol 2016, 2016:5234969.
- Белопольская М.А., Воронина О.И.. Беременность и вирусный гепатит // Вестник Российского университета дружбы народов. Серия: Медицина, no. 5, 2012, pp. 465-475.
- Ежлова Е.Б. и соавт. Вакцинопрофилактика вирусного гепатита // Инфекция и иммунитет, vol. 2, no. 1-2, 2012, pp. 440-440.
- Кузнецов Н.И. Вирусный гепатит // Российский семейный врач, vol. 16, no. 4, 2012, pp. 13-18.